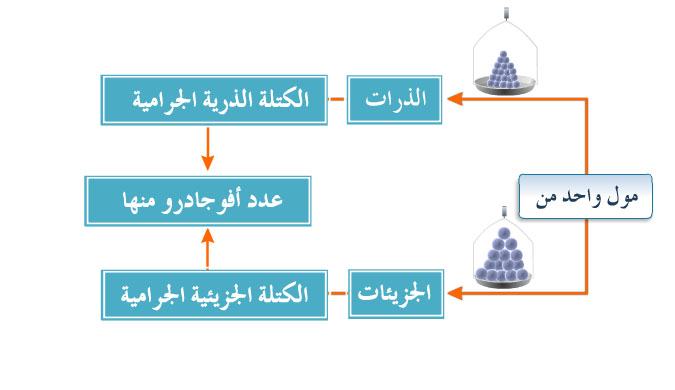
الكتلة المولية والحجم المولي
نشاط تعليمي يعرف المول /ذرة بأنه كمية من العنصر كتلتها مقدرة بالجرام وتساوي عدديا الكتلة الذرية النسبية له وتحتوي على عدد أفوجادرو من الذرات ويعرف المول /جزيء بأنه كمية من المادة كتلتها مقدرة بالجرام وتساوي عدديا الكتلة الصيغية ويحتوي على عدد أفوجادرو من الجزيئات و يذكر أن رمز العنصر أو الصيغة الكيميائية تدل على كمية منه مقدرها مول واحد ويحل مسائل لحساب عدد المولات للمادة بطريقة النسبة والتناسب، كما يحل مسائل لحساب عدد المولات [ عدد المولات = كتلة المادة جم/ كتلة المول ] ، و يحل مسائل لحساب عدد الذرات [ عدد المولات = عدد الذرات × الجزيئات/ عدد أفوجادرو]
|
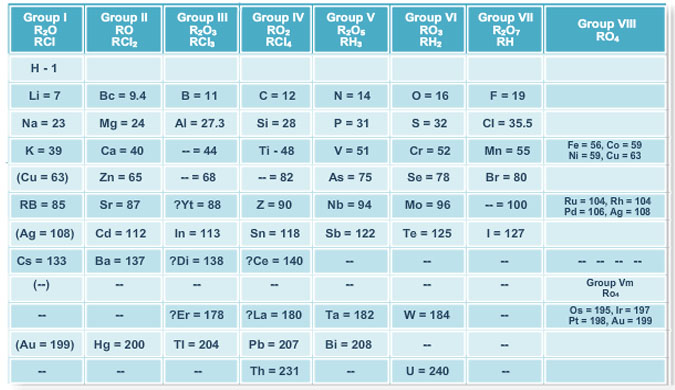
الجدول الدوري لمندليف
نشاط تعليمي يذكر أساس ترتيب العناصر في الجدول الدوري لمندليف و يصنف العناصر في جدول مندليف إلى مجموعات ودورات و يذكر مميزات الجدول الدوري لمندليف و يذكر نص القانون الدوري لمندليف.
|
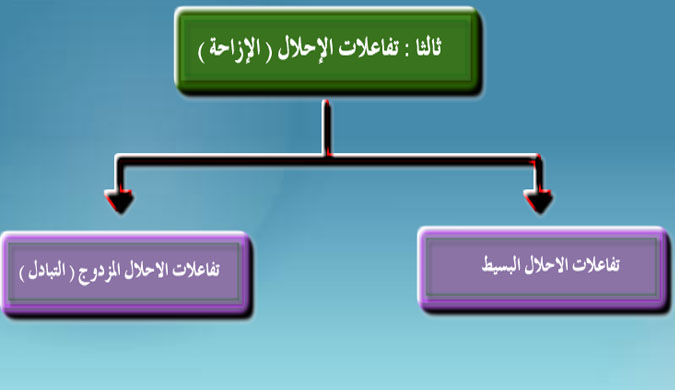
أنواع تفاعلات الإحلال
نشاط تعليمي يعبر عن تفاعلات الاحلال بالمعادلات التالية: احلال فلز محل هيدروجين الماء ↑2Na + H2O → 2NaOH + H2 احلال فلز محل هيدروجين الحمض ↑ Mg + H2SO4 → MgSO4 + H2 احلال فلز محل آخر في محلول ملحه ↓ Zu + CuSO4 → ZuSO4 + Cu ، و يتعرف على السلسلة الكهروكيميائية للعناصر حيث ترتيب العناصر ترتيبا تنازليا حسب نشاطها الكيميائي ويقارن نشاط الفلزات مع الهيدروجين حيث أن الفلز الأكثر نشاطا يحل محله وليس العكس و يعرف تفاعلات الاحلال البسيطة بأنه احلال عنصر نشيط كيميائيا محل عنصر آخر أقل منه نشاطا كما يستنتج أن الخارصين يحل محل الهيدروجين في محاليل الأحماض بينما لا يحل النحاس محله في محاليل الأحماض و يقسم تفاعلات الاحلال المزدوج (التبادل) إلى تفاعلات تعادل أو ترسيب و يعرف تفاعلات التعادل بأنها تفاعلات بين الأحماض والقواعد لتكوين ملح وماء ويعبر عن تفاعلات التعادل بمعادلة كيميائية NaOH + HCL → NaCl + H2O و يعرف تفاعلات الترسيب بأنها التبادل الأيوني في المحاليل المائية حيث يتكون مركب عديم الذوبان فيترسب و يعبر عن تفاعلات الترسيب بمعادلة كيميائية NaNO3+↓ AgNO3 + NaCl → AgCl
|